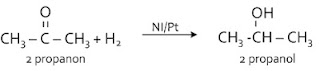
Reaksi-reaksi alkil halida
Dalam reaksi alkil halida ada dua reaksi yaitu reaksi
subsitusi dan reaksi eliminasi. Sebelum membahas lebih lanjut mengenai
reaksi-reaksi halida, kita kenal dulu mengenai teori asam basa.
1. Teori asam basa
lewis
Asam adalah penerima electron, sedangkan basa adalah pemberi
electron
Semua zat yang didefinisikan sebagai asam dalam teori
Arrhenius juga merupakan asam dalam kerangka teori Lewis karena proton adalah
akseptor pasangan elektron . Dalam reaksi netralisasi proton membentuk ikatan
koordinat dengan ion hidroksida.
H+ + OH– H2O (9.30)
Situasi ini sama dengan reaksi fasa gas yang pertama
diterima sebagai reaksi asam basa dalam kerangka teori Bronsted dan Lowry.
HCl(g) + NH3(g) NH4Cl(s) (9.31)
Dalam reaksi ini, proton dari HCl membentuk ikatan koordinat
dengan pasangan elektron bebas atom nitrogen.
Keuntungan utama teori asam basa Lewis terletak pada fakta bahwa beberapa
reaksi yang tidak dianggap sebagai reaksi asam basa dalam kerangka teori
Arrhenius dan Bronsted Lowry terbukti sebagai reaksi asam basa dalam teori
Lewis. Sebagai contoh reakasi antara boron trifluorida BF3 dan ion
fluorida F–.
BF3 + F––> BF4– … (9.32)
2. Teori asam basa
Arrhenius
Asam adalah yang menghasilkan ion H+, sedangkan basa adalah
yang menghasilkan ion OH-
HCl + aq –> H+(aq) + Cl–(aq) … (9.8)
NaOH + aq –> Na+(aq) + OH–(aq) …. (9.9)
3. Teori asam basa
bronstend-lowry
Asam adalah pemberi proton, sedangkan basa adalah penerima
proton
Teori Bronsted dan Lowry asam: zat yang menghasilkan dan
mendonorkan proton (H+) pada zat lain basa: zat yang dapat menerima proton (H+)
dari zat lain.
Berdasarkan teori ini, reaksi antara gas HCl dan NH3 dapat dijelaskan
sebagai reaksi asam basa, yakni
HCl(g) + NH3(g) –>NH4Cl(s) … (9.11)
simbol (g) dan (s) menyatakan zat berwujud gas dan padat.
Hidrogen khlorida mendonorkan proton pada amonia dan berperan sebagai asam.
Menurut teori Bronsted dan Lowry, zat dapat berperan baik sebagai asam maupun
basa. Bila zat tertentu lebih mudah melepas proton, zat ini akan berperan
sebagai asam dan lawannya sebagai basa. Sebaliknya, bila zuatu zat lebih mudah
menerima proton, zat ini akan berperan sebagai basa. Dalam suatu larutan asam
dalam air, air berperan sebagai basa.
Senyawa alkil halida cendrung mengalami polarisasi karena
perbedaan keelektronegatifan. Dalam reaksi alkil halide pun ada yang di sebut
nukleofil. Nukleofil itu sendiri adalah sebuah ion yang akan tertarik kuat ke sebuah
daerah yang bemuatan positif pada sesuatu lain. Nukleofil ini yang akan
menentukan reaksi alkil halide dapat terjadi subsitusi atau eliminasi.
Reaksi walden
Pada reaksi walden ada yang di katakana sebagai pusat kiral, pusat kiral itu
sendiri adalah atom C yang dapat mengikat 4 gugus yang berbeda. Contohnya atom
C dapat mengikat H, Br, Cl, F. untuk lebih jelasnya dapat dilihat pada gambar
:
Mungkin hanya ini yang dapat saya bahas pada blog saya kali
ini. saya masih membutuhkan bantuan teman teman untuk lebih memahami materi ini, ada hal yang
tidak saya ketahui dari materi ini. bagaimana bisa OH dapat di gantikan oleh Cl
sedangkan sifat merekan sama-sama basa, mohon penjelasannya. Terima kasih teman
..
Mohon maaf sebelumnya J